Redline-Klinische Studienvereinbarung Vorlage Kostenlos




Schließen Sie sich den weltweit größten Unternehmen an
Wie man ein PDF für die elektronische Unterschrift sendet









Warum sollten Sie pdfFiller für elektronische Signaturen und PDF-Bearbeitung wählen?

Plattformübergreifende Lösung

Unbegrenzter Dokumentspeicher

Weithin anerkannte Benutzerfreundlichkeit

Wiederverwendbare Vorlagen- und Formularbibliothek
Die Vorteile elektronischer Signaturen

Effizienz

Barrierefreiheit

Einsparmaßnahmen

Sicherheit

Rechtmäßigkeit

Nachhaltigkeit
Profitieren Sie von unkomplizierten eSignature-Workflows ohne Kompromisse bei der Datensicherheit

DSGVO-Konformität

SOC 2 Typ II zertifiziert

PCI DSS Zertifizierung

HIPAA-Konformität

CCPA-Konformität
Redline-Klinische Studienvereinbarungsvorlage in Minuten
pdfFiller ermöglicht es Ihnen, die Vorlage für klinische Prüfungsvereinbarungen schnell zu redlinieren. Die benutzerfreundliche Drag-and-Drop-Oberfläche des Editors sorgt für eine schnelle und benutzerfreundliche Unterzeichnung auf jedem Gerät.
PDFs online zu unterschreiben ist eine schnelle und sichere Möglichkeit, Dokumente jederzeit und überall zu validieren, sogar unterwegs.
Gehen Sie die Schritt-für-Schritt-Anleitung durch, wie Sie die Vorlage für klinische Prüfungsvereinbarungen elektronisch mit pdfFiller redlinieren:
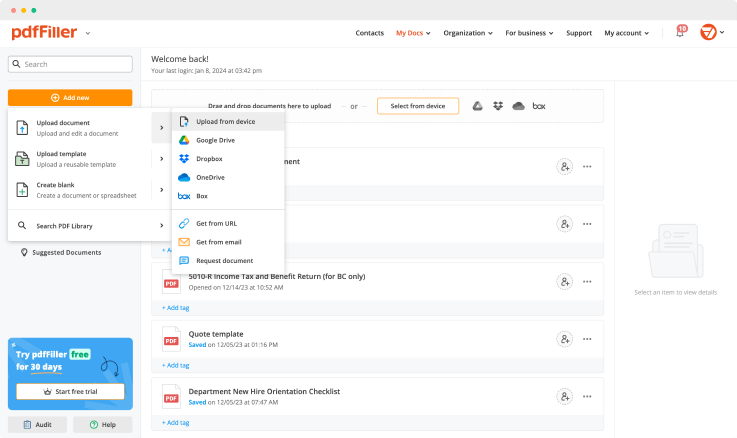
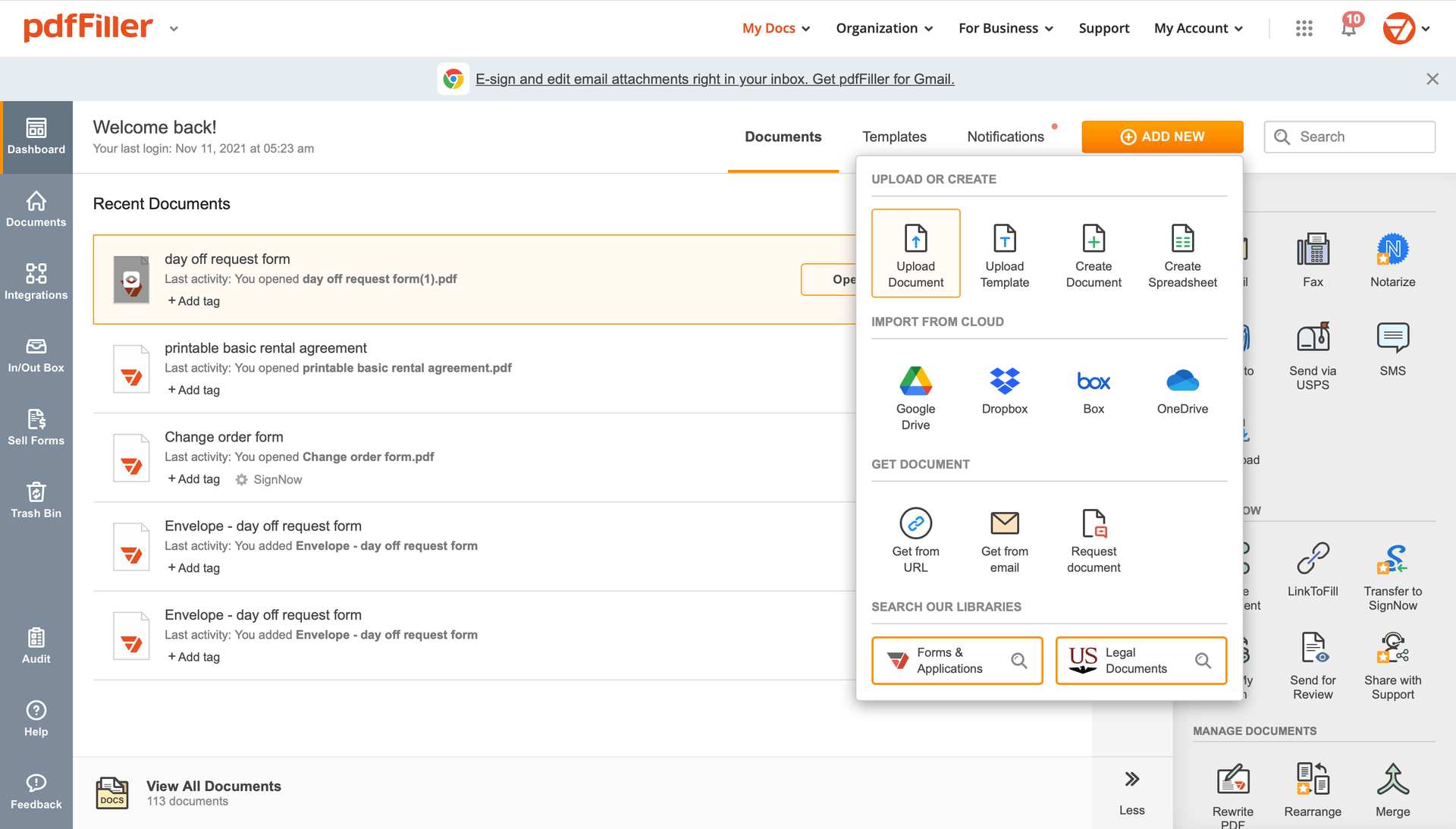
Fügen Sie das Dokument, das Sie unterschreiben müssen, von Ihrem Gerät oder Cloud-Speicher zu pdfFiller hinzu.
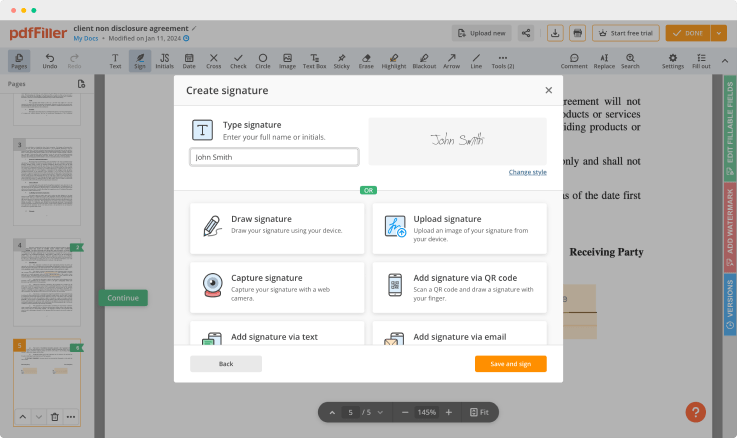
Sobald die Datei im Editor geöffnet ist, klicken Sie auf Signieren in der oberen Symbolleiste.

Erstellen Sie Ihre elektronische Unterschrift, indem Sie tippen, zeichnen oder das Bild Ihrer handschriftlichen Unterschrift von Ihrem Laptop hinzufügen. Klicken Sie dann auf Speichern und unterschreiben.
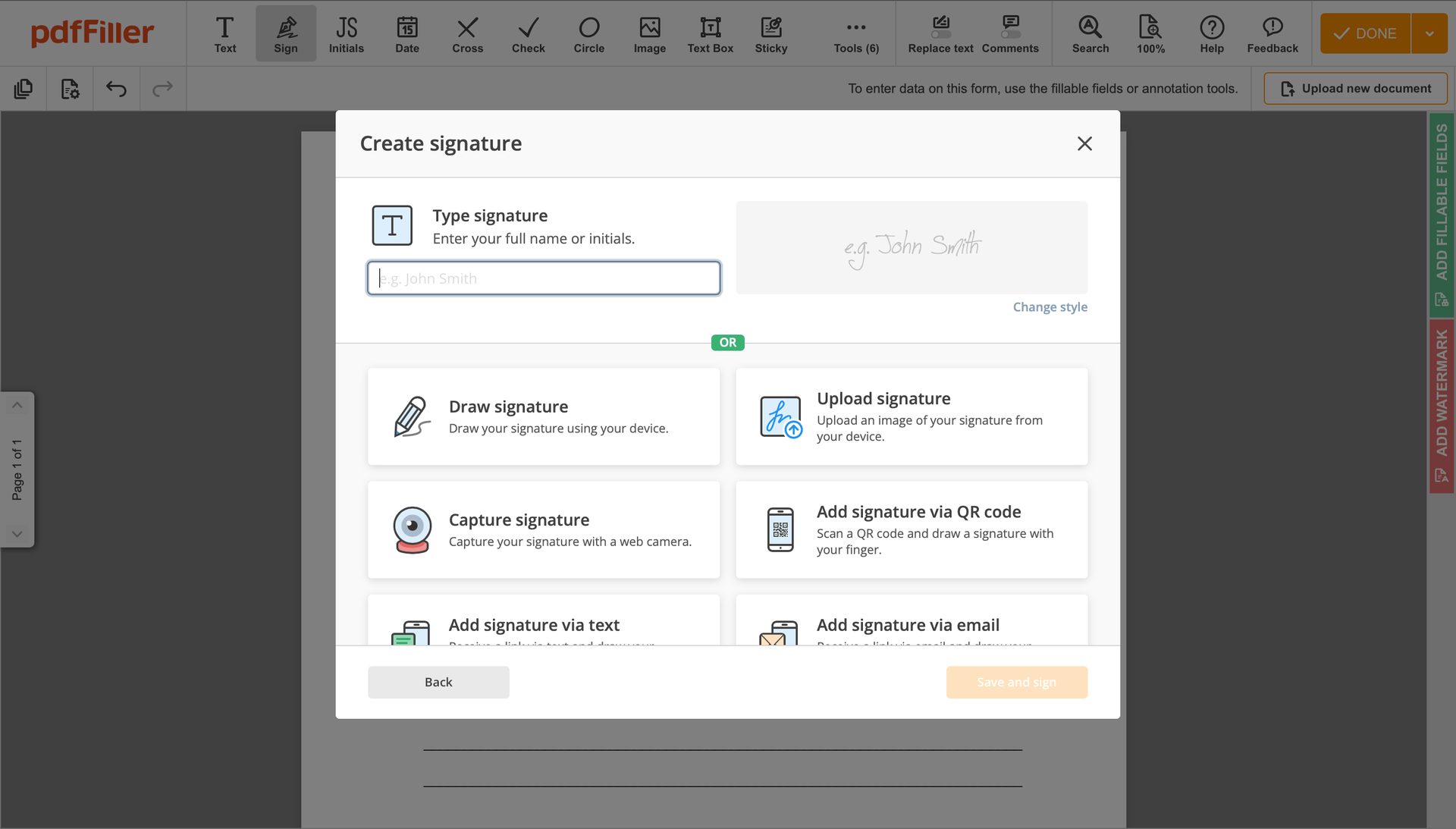
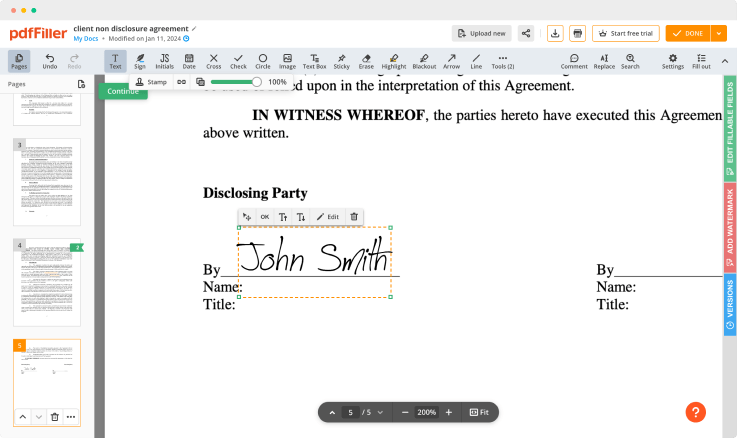
Klicken Sie irgendwo auf ein Dokument, um die Vorlage für klinische Prüfungsvereinbarungen zu redlinieren. Sie können es verschieben oder mit den Steuerelementen im schwebenden Panel die Größe ändern. Um Ihre Unterschrift zu verwenden, klicken Sie auf OK.
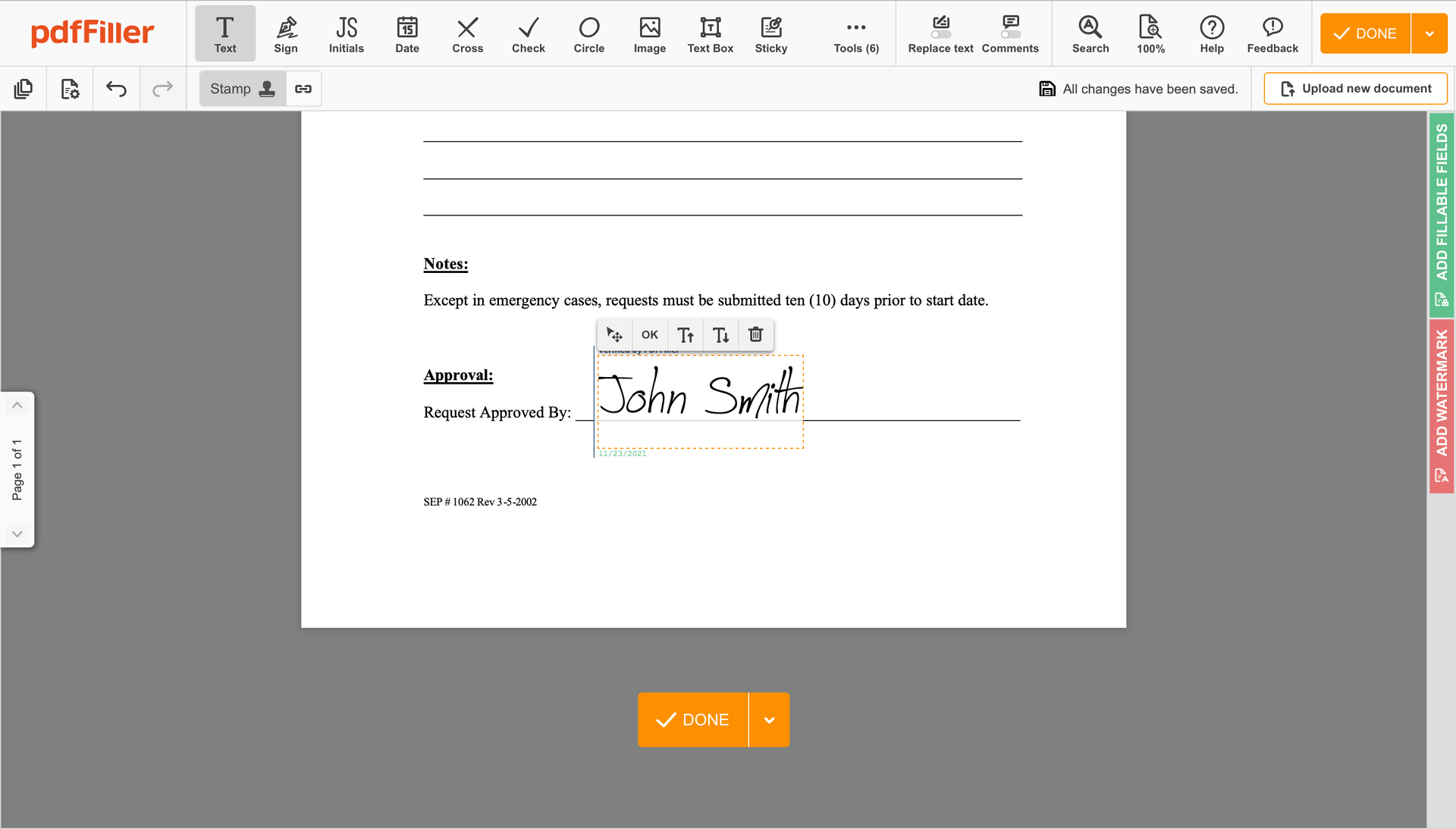
Beenden Sie die Unterschriftensitzung, indem Sie auf FERTIG unter Ihrem Formular oder in der oberen rechten Ecke klicken.
Danach kehren Sie zum pdfFiller-Dashboard zurück. Von dort aus können Sie eine ausgefüllte Kopie herunterladen, das Dokument drucken oder es anderen Personen zur Überprüfung oder Validierung senden.
Haben Sie Schwierigkeiten mit zahlreichen Anwendungen zur Verwaltung von Dokumenten? Probieren Sie stattdessen diese All-in-One-Lösung aus. Nutzen Sie unsere Plattform, um den Prozess effizient zu gestalten. Erstellen Sie Dokumentvorlagen komplett von Grund auf, ändern Sie vorhandene Formulare und andere nützliche Funktionen, ohne Ihren Browser zu verlassen. Sie können die Vorlage für klinische Prüfungsvereinbarungen ganz einfach verwenden; alle unsere Funktionen sind sofort für alle Benutzer verfügbar. Haben Sie einen Vorteil gegenüber anderen Programmen.
So bearbeiten Sie ein PDF-Dokument mit dem pdfFiller-Editor:
So verwenden Sie die Redline-Vorlage für klinische Studienverträge
Wir verstehen, dass die Verwendung der Redline Clinical Trial Agreement Template-Funktion anfangs etwas überwältigend sein kann. Aber keine Sorge, wir sind hier, um Sie Schritt für Schritt durch den Prozess zu führen!
Wir hoffen, dass dieser Schritt-für-Schritt-Leitfaden Ihnen hilfreich war. Wenn Sie weitere Fragen haben oder Unterstützung benötigen, zögern Sie nicht, sich an unser Support-Team zu wenden. Viel Spaß beim Erstellen von Vorlagen!
FAQs über pdfFiller
Bereit, pdfFillerauszuprobieren? Redline-Klinische Studienvereinbarung Vorlage Kostenlos